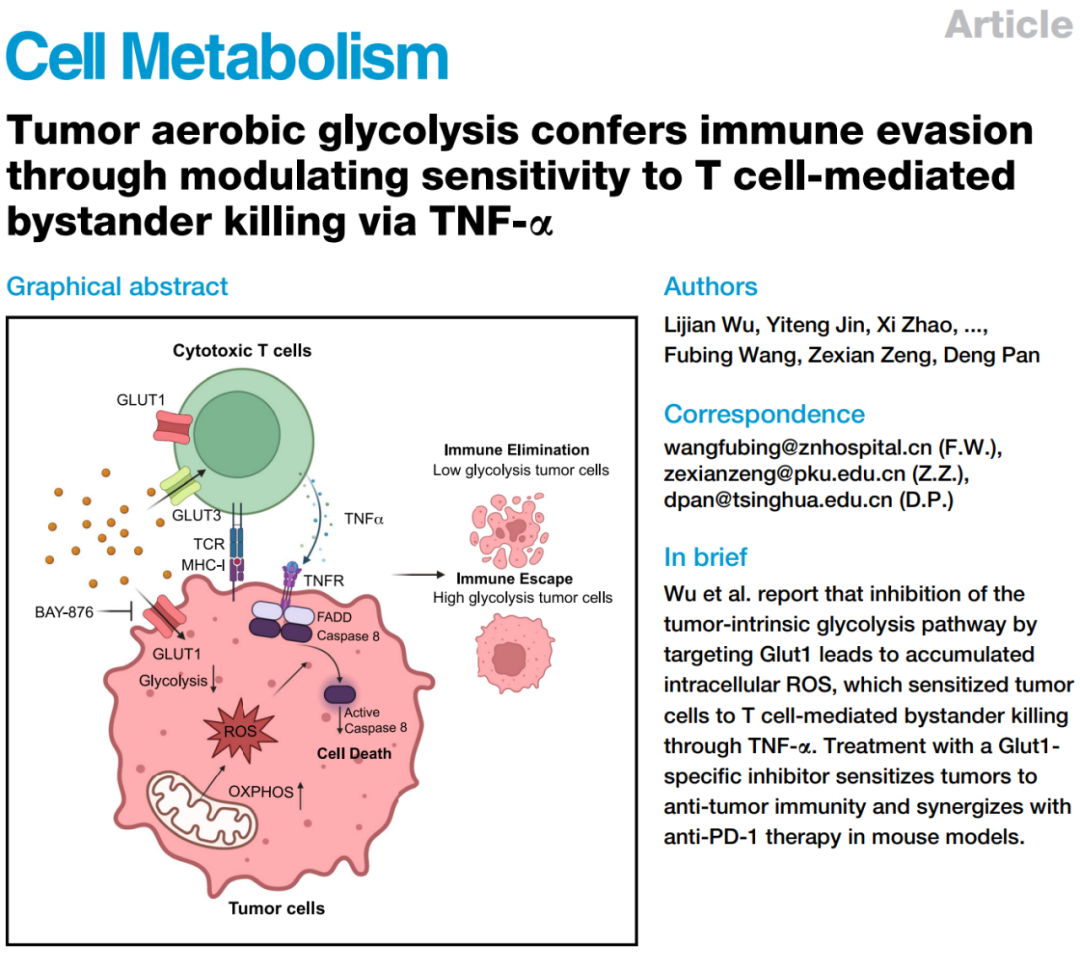
癌症免疫逃逸是肿瘤发展的重要机制之一,限制了免疫治疗的效果。最近,清华大学、北京大学和武汉大学的团队展开了强强合作,揭示了有氧糖酵解调控癌症免疫逃逸的全新机制。这一发现为克服癌症免疫逃逸提供了新的思路,并有望为免疫治疗的改进和优化提供新的策略。
有氧糖酵解是一种重要的能量产生途径,它在正常细胞中起着关键的代谢作用。然而,在肿瘤细胞中,有氧糖酵解过程被过度激活,导致肿瘤细胞对免疫系统攻击的逃逸。为了探索有氧糖酵解在癌症免疫逃逸中的作用,清华大学、北京大学和武汉大学的团队展开了卓有成效的合作研究。
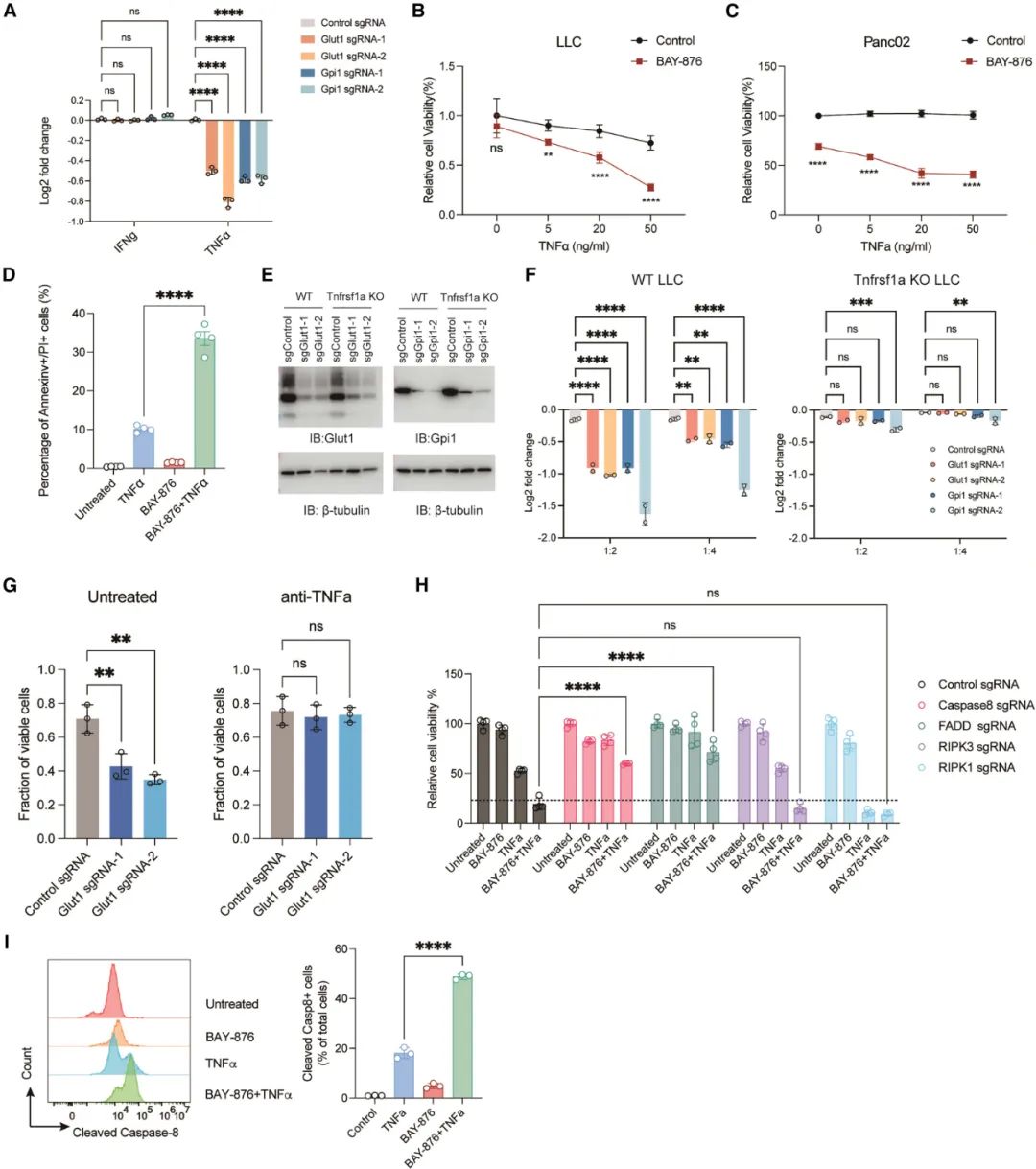
▲敲除Glut1可通过代谢重编程,增敏TNF-α诱导的癌细胞凋亡
研究团队发现,在肿瘤细胞中,有氧糖酵解通过调节乳酸的产生和释放,进而抑制免疫反应。具体而言,肿瘤细胞通过增加乳酸的产生,降低细胞外pH值,从而抑制T细胞的活性。此外,乳酸还能够直接抑制T细胞功能和增加免疫抑制性细胞(如调节性T细胞)的数量。这一发现揭示了有氧糖酵解在癌症免疫逃逸中的重要作用。
进一步的研究表明,有氧糖酵解通过调节乳酸转运蛋白MCT4的表达来实现对免疫逃逸的调控。抑制MCT4的表达能够减少肿瘤细胞释放的乳酸,恢复肿瘤微环境的酸碱平衡,增强T细胞的活性,并降低免疫抑制性细胞的数量。因此,针对MCT4的干预可能成为克服癌症免疫逃逸的新策略。
清华大学、北京大学和武汉大学的团队揭示了有氧糖酵解调控癌症免疫逃逸的全新机制。他们发现有氧糖酵解通过调节乳酸的产生和释放,抑制了免疫系统对肿瘤细胞的攻击。这一发现为克服癌症免疫逃逸提供了新的思路,并可能为免疫治疗的改进和优化提供新的策略。未来的研究将进一步探索有氧糖酵解在癌症免疫逃逸中的详细机制,并开发针对MCT4的干预方法。


