
癌症一直是困扰人类健康的严重问题,而c-Src作为一个关键的癌基因,在癌症的发生和发展中发挥着重要作用。近年来的研究表明,c-Src不仅仅是一个信号传导分子,更是一个能够自我激活的蛋白质。本文将深入探讨c-Src的结构、功能以及自我激活的机制,以期为癌症治疗提供新的靶点和策略。
c-Src是一种酪氨酸激酶,属于Src家族。它在正常细胞中参与多种生物学过程,包括细胞生长、分化、黏附和迁移。然而,在某些情况下,c-Src的异常激活与多种癌症的发生和发展密切相关。研究发现,c-Src能够通过自我激活机制在细胞内传递异常的信号,促使癌细胞的快速增殖和侵袭。为了更好地理解c-Src的自我激活机制,研究人员进行了大量的实验和研究。
c-Src的结构和功能:
c-Src蛋白质由多个结构域组成,包括N-末端SH4域、肽酶激活区、酪氨酸激酶区、C-末端的负调控区等。这些结构域共同作用,形成一个复杂而精密的蛋白质结构。c-Src的功能主要通过其酪氨酸激酶活性实现,该活性受到多种因素的调控。
c-Src的自我激活机制:
c-Src的自我激活机制是一个复杂的过程,涉及到多个结构域和信号分子的相互作用。一般而言,c-Src的自我激活可以分为以下几个步骤:
1.解除负调控: c-Src的C-末端负调控区通过与其它结构域相互作用,抑制了其酪氨酸激酶活性。在自我激活过程中,某些信号分子的介入可能导致这一区域的解除,释放负调控,使得c-Src的活性得以提高。
2.磷酸化: 磷酸化是c-Src自我激活的关键步骤之一。磷酸化可以改变c-Src的构象,使其更容易与底物结合,从而增强其酪氨酸激酶活性。激酶区的磷酸化和解磷酸化过程是c-Src活性调控的主要手段之一。
3.与膜相关的事件: c-Src与细胞膜的相互作用也是其自我激活的重要机制之一。一些信号分子的介入可能导致c-Src与膜结合,从而改变其构象并促使其酪氨酸激酶活性的增强。
4.蛋白质相互作用: c-Src与其他信号分子和蛋白质的相互作用也是其自我激活的重要方面。例如,与适当的配体结合可以诱导c-Src的构象变化,从而增强其酪氨酸激酶活性。
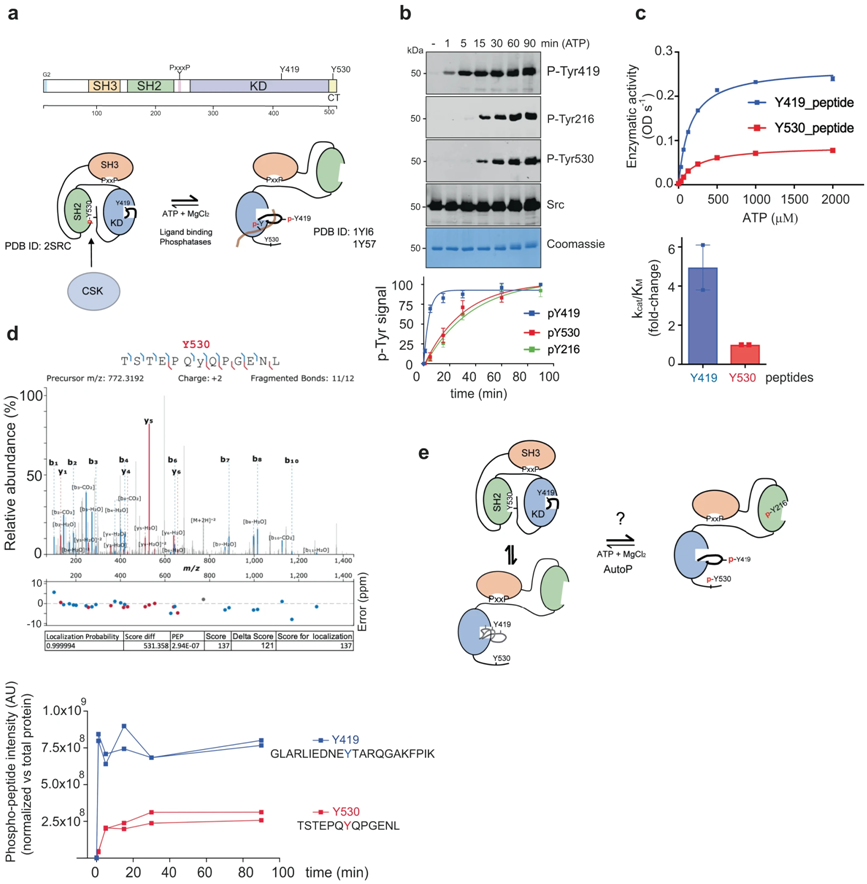
▲c-Src的自我磷酸化动力学。
结论:
c-Src作为一个关键的癌基因,在癌症的发生和发展中发挥着重要作用。其自我激活机制的揭示为癌症治疗提供了新的思路和方向。通过深入研究c-Src的结构、功能以及自我激活的机制,我们或许能够开发出更有效的治疗手段,以期更好地抑制癌症的发展。这也为未来癌症治疗研究提供了一个富有挑战性和前景广阔的领域。


